2023年12月17日,我院李伟广研究员与中国科学院上海有机化学研究所陈以昀研究员团队、上海交通大学医学院徐天乐教授团队合作,在美国化学会综合性旗舰期刊《ACS Central Science》上在线发表题为“Genetically Encoded Photocatalysis Enables Spatially Restricted Optochemical Modulation of Neurons in Live Mice”的研究论文。该研究成功开发了一种遗传编码的光催化小分子释放技术用于神经元精准调控。该技术通过生物正交光催化硼酸去笼反应,空间特异性地光控释放生物活性小分子,进而在活细胞、离体神经元和活体小鼠中实现了亚细胞特异性、神经投射特异性及细胞类型特异性的神经元光化学调控。该技术通过活体小鼠内的生物正交光催化特异性释放GABA(B)受体激动剂——巴氯芬,揭示了NaV1.8+神经元是外周GABA能痒觉调控的关键作用细胞类型。

光为神经元调控提供了高时空精度。小分子具有结构多样性,可以适用于多种蛋白质靶标,在神经元调控中极具优势。当前使用光化学方法释放的小分子自由扩散,在光照区域内具有均匀浓度,缺乏遗传编码的光敏蛋白(如光遗传学)所具有的空间特异性。遗传编码的光催化反应通过在光催化剂附近产生和释放活性物质,基于“邻近效应”为特定蛋白靶标干预提供卓越的空间特异性。然而,当前的遗传编码光催化方法主要使用抗体标记的重金属光催化剂实现空间特异性,在脆弱敏感的神经系统的适用性有限。中国科学院上海有机化学研究所陈以昀课题组长期致力于发展基于有机硼酸的可见光催化与光化学反应,曾与上海交通大学医学院徐天乐教授课题组合作,将常用于荧光成像的有机荧光分子作为生物相容的光催化剂,在细胞内利用氧气及抗氧化剂通过光催化氧化还原反应产生过氧化氢,从而进行脱硼羟基化反应去笼释放生物活性分子。该方法可通过光控释放巴氯芬,在小鼠脑片神经元上实现了对GABA(B)受体的高时空分辨率调节(Angew. Chem., Int. Ed., 2019)。在本研究中,研究团队致力于进一步开发基于遗传编码的生物相容可见光化学反应体系,通过遗传学手段定义特定的细胞类型或细胞区室(图1),旨在实现空间方位特异的光催化调控。
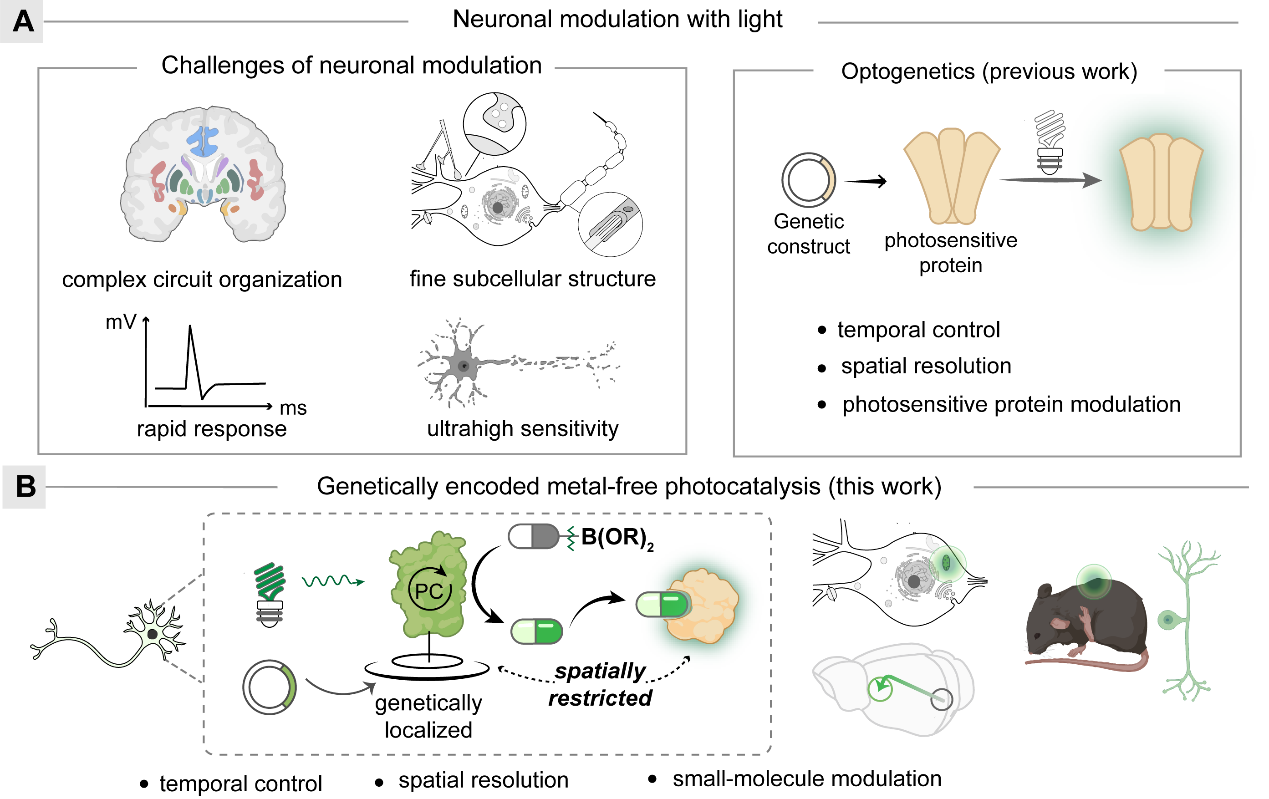
图1.神经光调控与遗传编码的光催化小分子调控。
在前述工作的基础上,合作团队设计合成了双功能配体-有机染料小分子BGFL,可以在活细胞内与SNAP-tag蛋白偶联得到可遗传编码的杂合蛋白光催化剂SNAP-FL。该蛋白光催化剂SNAP-FL具有优秀的光催化性质与光化学稳定性,可在体外及体内高效快速生成超氧自由基阴离子促进脱硼羟基化反应释放生物活性小分子(图2A)。基于该杂合蛋白光催化剂的可遗传编码性,该方法在线粒体、细胞核、内质网、细胞质等亚细胞器均可实现空间特异性的光催化释放荧光小分子与抗癌药物阿霉素(DOX),从而实现了亚细胞特异性的光调控蛋白质功能(图2B)。该光催化小分子调控方法在离体神经元中通过光催化释放线粒体解偶联剂DNP实现了线粒体膜电位的靶向调控(图2C)。
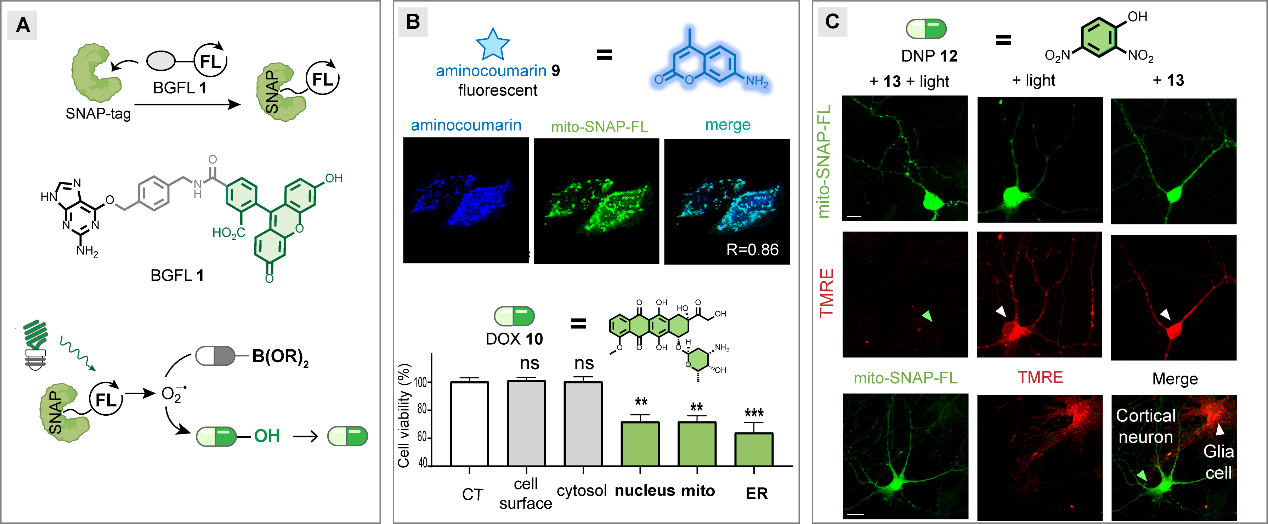
图2.遗传编码的光催化小分子调控多种细胞及神经功能。
利用该方法,研究人员进一步实现了对长程神经投射突触的精准控制。研究人员将SNAP-tag蛋白表达在皮层→杏仁核长程神经投射,通过与双功能配体-有机染料小分子BGFL偶联得到杂合蛋白光催化剂SNAP-FL,进一步融合光遗传学技术,在小鼠皮层-杏仁核神经投射同时实现了对突触传递的光化学调节和光遗传学/电生理功能测量。研究发现,光化学反应驱动释放的小分子巴氯芬具有神经投射特异性,可仅在特定的神经投射突触前激活GABA(B)受体,并不影响其他区域。该技术不仅通过光遗传学锚定单类神经投射进行刺激,还通过遗传编码的光化学反应实现特定神经投射的小分子局部精准释放,为神经科学研究者提供了更灵活、更强大的实验手段。
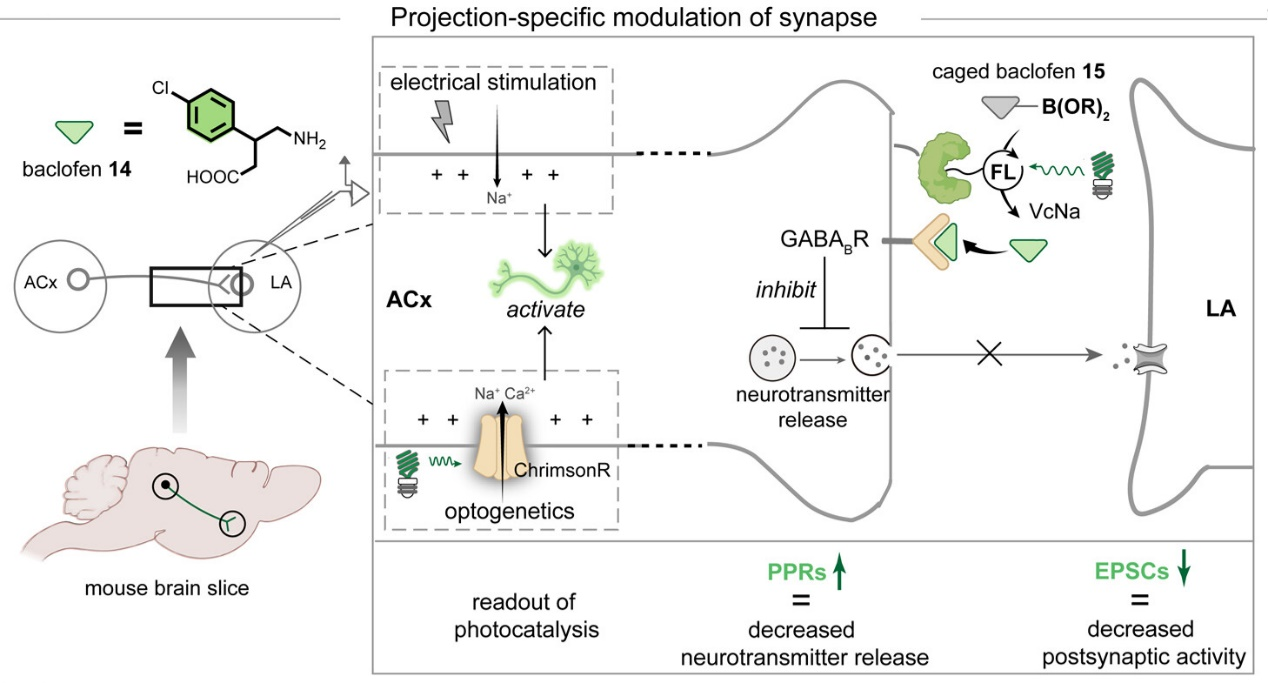
图3.遗传编码光催化小分子释放技术对于长程神经投射突触的特异性影响。
在活体小鼠实验中,研究人员通过绿光照射小鼠皮肤首次实现了光催化释放小分子巴氯芬有效缓解瘙痒。研究人员比较了NaV1.8+感觉神经末梢的特异性释放与泛外周神经元末梢的广泛性释放分别对小鼠瘙痒的影响,发现只有前者特异性的光控释放可有效缓解小鼠的痒觉抓挠行为,提示NaV1.8+神经元是外周GABA(B)受体调节痒觉信息传递的关键作用细胞类型(图4)。
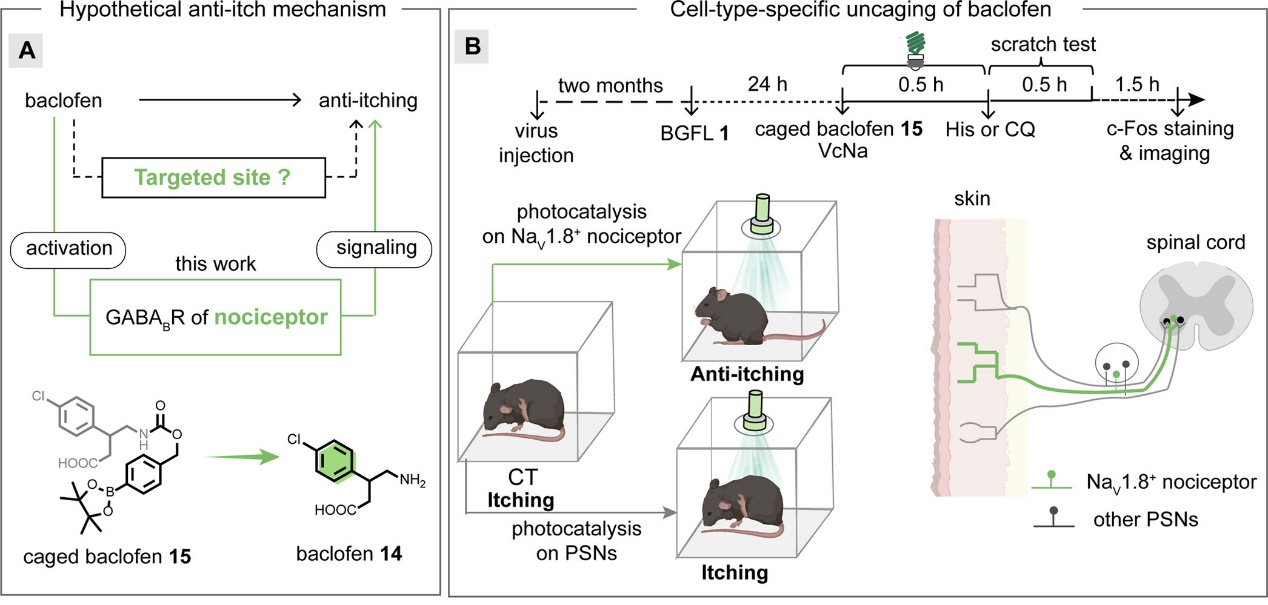
图4.利用遗传编码光催化小分子释放技术解析活体动物感觉传递调控通路。
总之,该遗传编码的可见光催化技术为分子定义的神经元类型及其特定区室的多样化蛋白靶点即时调控提供了全新途径,克服了传统光催化方法中金属光催化剂的神经毒性和抗体靶向能力不足的多项挑战,为神经科学的光调控应用提供全新的工具。上述研究成果发表在ACS Central Science,其科学概念图被选为杂志正封面(Front Cover)。
中国科学院上海有机化学研究所/上海科技大学联合培养博士研究生曾凯星与上海交通大学医学院博士研究生焦志涵为共同第一作者,中国科学院上海有机化学研究所陈以昀研究员、上海交通大学医学院徐天乐教授和我院李伟广研究员为论文的共同通讯作者。该研究得到国家自然科学基金委重点项目、中国科学院创新交叉团队项目、上海市科学技术委员会、上海交通大学医学院、生命过程小分子调控全国重点实验室等各级项目的支持。
论文链接:https://doi.org/10.1021/acscentsci.3c01351