一 小胶质细胞的碎片清除是重要且被忽视的生物学过程
小胶质细胞是中枢神经系统(CNS)内重要的免疫细胞,在CNS发育、稳态维持和神经退行性病变等多个生理和病理进程中起关键作用。作为CNS内的专业吞噬细胞,小胶质细胞通过吞噬作用(phagocytosis)承担着清除死亡细胞碎片、树突棘、细胞外基质和入侵病原体等功能1-6。当细胞碎片不能被及时清除时,将引起CNS功能紊乱,包括炎症水平的上升等7,8。因此,小胶质细胞的高效吞噬能力对于维持CNS稳态和功能至关重要1-3,6。
然而,不同于在成年后可终生维持的神经细胞,小胶质细胞在机体的全生命周期内持续性进行细胞更替(turnover)。在此过程中,衰老的小胶质细胞死亡伴随着新生小胶质细胞的再生9-13。小胶质细胞通过自我更新(self-renewal)的方式再生,并且与衰老细胞的死亡相偶联,从而维持小胶质细胞数量的稳定14。在稳态情况下,人和小鼠每年有约30%的小胶质细胞发生更替13,15。换而言之,正常的脑内每年有将近三分之一的小胶质细胞死亡。在疾病状态下,小胶质细胞的更替速度则更快15,16。如果死亡小胶质细胞所产生的碎片不能及时被清除,其将会在脑内大量积累引起CNS的功能紊乱,以及加速神经退行性病变的病理进程7,8。此外,近年来研究发现通过抑制集落刺激因子1受体(CSF1R)等方式可在短时间内快速杀死脑内超过99%的小胶质细胞。然而,在此过程中并未伴随大量的细胞碎片聚集,且检测不到炎症反应17-20。由此可见,机体内存在高效的清除死亡小胶质细胞碎片的机制。因此,研究小胶质细胞碎片如何被清除对理解CNS的稳态维持和神经退行性病变机理至关重要。
领域内对于小胶质细胞碎片清除的途径和机理研究却被长期忽视,主要因为三个原因:(1)小胶质细胞自身承担着专业吞噬细胞角色,研究人员通常将关注点集中在小胶质细胞如何吞噬其他类型细胞死亡后产生的碎片,而忽视了小胶质细胞本身死亡后的碎片如何被清除。(2)小胶质细胞更替所产生的细胞碎片若不能被清除,长时间积累会产生大量的碎片累积。但在稳态情况下,小胶质细胞的的实时更替速率相对较慢,每天仅有约0.1%的小胶质细胞死亡13,15。较低的小胶质细胞实时死亡速率使得脑内的小胶质细胞碎片较少,不便于对吞噬小胶质细胞碎片的细胞类型进行筛选和研究。(3)人们推测小胶质细胞的碎片可能是由小胶质细胞的吞噬作用进行清理。然而,小胶质细胞碎片携带正常小胶质细胞的分子标志物(如IBA1和CX3CR1等),难以通过传统的在体实验方法区分小胶质细胞内吞噬的同类型细胞碎片。由于这三个主要原因,领域内对小胶质细胞碎片清除这一重要生物学过程的研究被长期忽视。
二 小胶质细胞碎片由C4b介导的途径被星形胶质细胞吞噬,并通过非经典自噬途径进行降解
bwin必赢彭勃团队长期专注于小胶质细胞更替的研究。该团队前期系列研究工作阐明了小胶质细胞在更替过程中新生小胶质细胞的起源和迁移机制(图1)(Nature Neuroscience, 2018和Cell Discovery, 2018)17,20,并以此为基础开发了3种不同的小胶质细胞替换策略(图1)(Cell Reports, 2020)21,为神经系统疾病提供了新的治疗思路和可临床实现的方案。此外,该团队进一步发现NeuroD1可通过BCL2途径介导小胶质细胞凋亡,提出可利用该途径作为分子开关(switch-off control),增强小胶质细胞替换疗法的安全性(Neuron, 2021)(图1)22。该团队在其前期研究的基础上,利用多种研究手段,进一步探究了小胶质细胞在更替过程中死亡细胞碎片的清除机制。该研究成果以Microglial debris is cleared by astrocytes via C4b-facilitated phagocytosis and degraded via RUBICON-dependent noncanonical autophagy in mice为题发表在Nature Communications上(图1-2)(Nature Communications, 2022)23。

图1 彭勃团队近年来围绕小胶质细胞更替取得的学术成果。

图2 论文首页
由于在生理情况下,小胶质细胞的更替速率较慢,产生的小胶质细胞碎片很少,不利于对执行碎片吞噬功能的细胞类型进行筛选和观察。因此,彭勃团队首先通过CSF1R抑制剂PLX5622杀死脑内的小胶质细胞,以在短时间内产生大量细胞碎片的方式对中枢神经系统内的主要细胞类型(含星形胶质细胞、Müller胶质细胞、少突胶质细胞及其前体细胞、周细胞、平滑肌细胞、神经元细胞、神经干细胞、CNS巨噬细胞)进行观察和筛选。该团队发现,仅有星形胶质细胞(脑、视网膜和脊髓)和Müller胶质细胞(视网膜内特有的一类胶质细胞)在此时表现出对小胶质细胞碎片的吞噬能力。进一步,研究人员通过观察星形胶质细胞在稳态和疾病状态下,对自然更替下产生的小胶质细胞碎片的吞噬情况,发现其吞噬速率与不同区域小胶质细胞更替速率成正相关,证明星形胶质细胞对小胶质细胞碎片的吞噬作用具有重要的生理和病理意义。
下一步,研究团队通过低浓度他莫昔芬对P2Y12-CreER-GFP::Ai14和CX3CR1-CreER::Ai14进行稀疏标记,以此为方法探索小胶质细胞作为脑内专业吞噬细胞,是否能清除同类型细胞死亡后所产生的细胞碎片。该团队发现,在体内条件下,小胶质细胞不能吞噬死亡小胶质细胞所产生的的碎片(无论在稳态还是人为诱导产生小胶质细胞碎片的情况下)。随后,该团队通过体外实验,发现小胶质细胞具备吞噬同类型细胞碎片的能力。然而,由于在体内条件下的距离依赖性竞争,使得在体内条件下,该过程不会发生。因此,该团队证明了脑内的小胶质细胞碎片由星形胶质细胞负责清除(图2)。
进一步,该团队探索了星形胶质细胞吞噬和降解小胶质细胞碎片的机制,发现补体C4b能促进星形胶质细胞对小胶质细胞碎片的吞噬作用。而在星形胶质细胞体内,小胶质细胞碎片通过RUBICON依赖的非经典自噬途径(又称为LC3相关胞吞作用)进行降解(图2)。
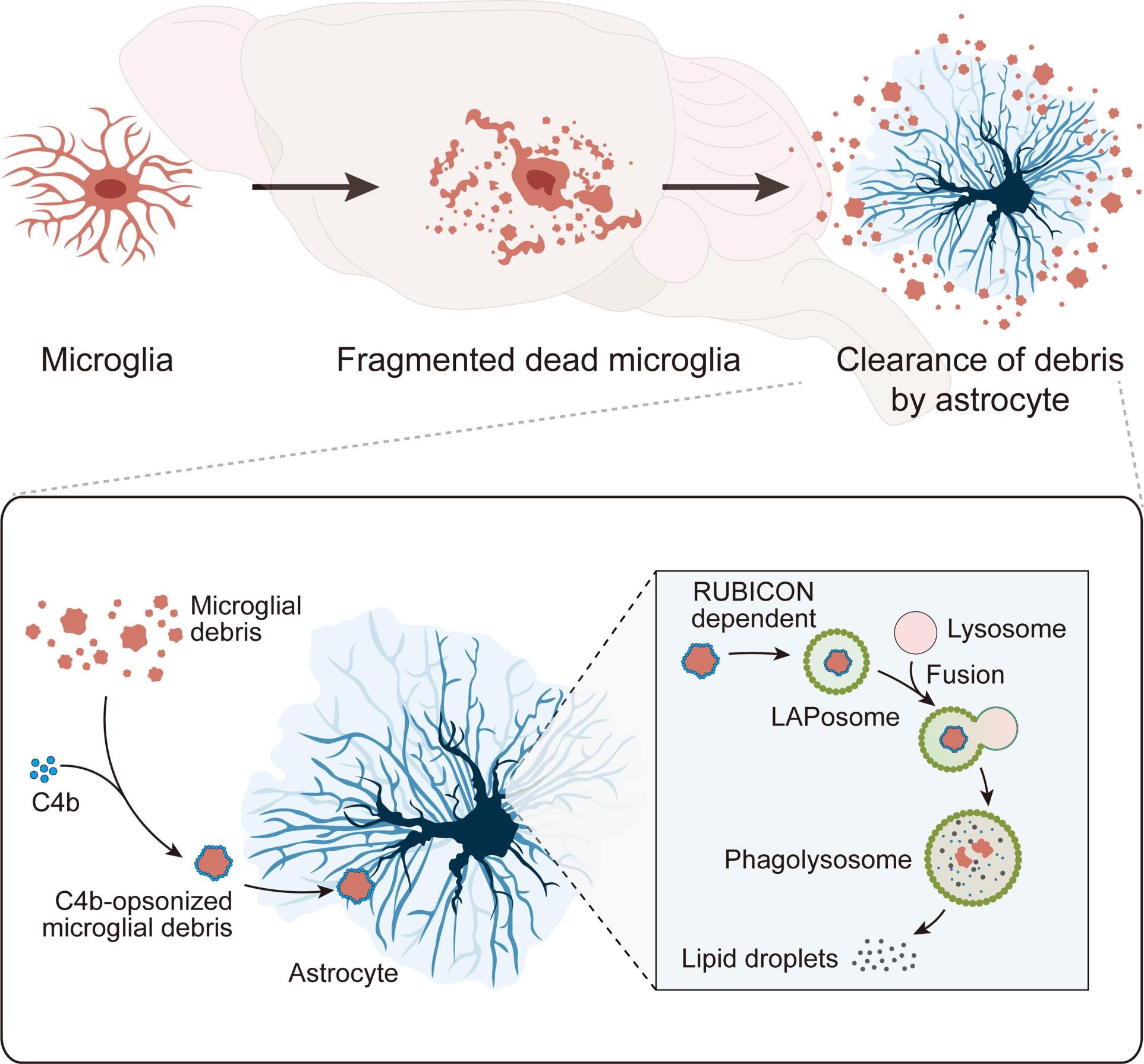
图2 小胶质细胞碎片的清除机制示意图。

图3 星形胶质细胞和Müller胶质细胞在大快朵颐吃火锅(小胶质细胞碎片)。
bwin必赢彭勃教授是本论文的通讯作者,团队周添博士为第一作者。本研究得到了bwin必赢/浙江大学段树民院士、南方医科大学高天明院士、华山医院毛颖院长、bwin必赢饶艳霞教授、华东师大李大力教授、上海交大附属精神卫生中心袁逖飞教授、南昌大学彭吉云教授、锦州医科大学梅晰凡教授、南科大姬生健教授,以及bwin必赢舒友生教授、郭非凡教授和陆巍教授等学者的帮助。该论文在中国脑计划重大项目、国家自然科学基金优青/面上项目、教育部科技领军人才团队、上海市基础研究学术特区、上海市优秀学术带头人等项目的资助下完成。论文全文https://www.nature.com/articles/s41467-022-33932-3。
彭勃课题组目前有青年研究员(教授)、青年副研究员(副教授)和博士后的岗位,欢迎对科研充满热情且胸怀学术理想的科研人员/同学加入。申请人请将一份详细的个人完整简历(中英文皆可)通过电子邮件发送至peng@fudan.edu.cn,邮件标题请注明姓名+应聘职位。青年副研究员(副教授)和博士后应聘者请提供2~3位推荐人的联系方式。
通讯作者彭勃教授介绍:
国家优青,科技创新2030脑科学与类脑研究(中国脑计划)重大项目首席科学家,教育部科技领军人才团队负责人、上海市优秀学术带头人(青年),博士生导师,脑科学转化研究院院长助理。2004至2008年就读于华中科技大学生物技术专业,获学士学位。2008至2011年在中国科学院神经科学研究所学习神经生物学。2015年毕业于香港大学,获博士学位。2015年12月,在中国科学院深圳先进技术研究院组建独立的神经免疫学实验室,担任课题组长(PI)。2019年9月加入bwin必赢。
彭勃课题组主要关注中枢神经系统内小胶质细胞的更替(包括细胞的衰老、死亡和再生等)、细胞重编程,以及在多种神经退行性病变中以小胶质细胞替换/移植为思路开展干预和治疗的全新策略。此外,课题组关注小胶质细胞在中枢神经系统稳态维持中的相关机理。自课题组成立以来,主要成果以通讯作者发表在Nature Neuroscience, Neuron, Cell Reports, Nature Communications, eLife和Cell Discovery等重要刊物上。彭勃课题组的研究工作入选Nature Reviews Immunology评选的2018年度神经免疫学进展(Year In Review: Neuroimmunology 2018),全球共5个工作入选。自2020年起,彭勃被ELSEVIER(爱思唯尔)连续评为中国高被引学者。此外,彭勃在包括Nature Neuroscience和Nature Aging在内的多个重要学术刊物担任特邀审稿人。
附:彭勃课题组近四年发表的代表性论文
(1) Rao Y.*, Du S., Yang B., Wang Y., Li Y., Li R., Zhou T., Du X., He Y., Wang Y., Zhou X., Yuan T.-F.*, Mao Y.* and Peng B.* (2021) NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming, Neuron, 109.
(2) Huang Y.#, Xu, Z.#, Xiong S., Sun F., Qin G., Hu G., Wang J., Zhao L., Liang Y.-X., Wu T., Lu Z., Humayun M.S., So K.-F., Pan Y., Li N., Yuan T.-F.*, Rao Y.* and Peng B.* (2018). Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nature Neuroscience 21, 530-540.
(3) Xu Z.#, Rao Y.#, Huang Y., Zhou T., Feng R., Xiong S., Yuan T.F., Qin S., Lu Y., Zhou X., Li X., Qin B., Mao Y., and Peng B.* (2020). Efficient strategies for microglia replacement in the central nervous system. Cell Reports 32, 108041.
(4) Huang Y.#, Xu Z.#, Xiong S., Qin G., Sun F., Yang J., Yuan T.F., Zhao L., Wang K., Liang Y.X., Fu L., Wu T., Lu Z., So K.F., Rao Y.* and Peng B.* (2018) Dual origins of retinal microglia in the model of microglia repopulation. Cell Discovery 4, 9.
(5) Zhou T., Li Y., Li X., Zeng F., Rao Y., He Y., Wang Y., Liu M., Li D., Xu Z., Zhou X., Du S., Niu F., Peng J., Mei X., Ji S.-J., Shu Y., Lu W., Guo F., Wu T., Yuan T.-F., Mao Y. and Peng B.* (2022) Microglial debris is cleared by astrocytes via C4b-facilitated phagocytosis and degraded via RUBICON-dependent noncanonical autophagy in mice. Nature Communications.
(6) Niu F., Han P., Zhang J., She Y., Yang L., Yu J., Zhuang M., Tang K., Shi Y., Yang B., Liu C., Peng B.* and Ji S.-J.* (2022) The m6A reader YTHDF2 is a negative regulator for dendrite development and maintenance of retinal ganglion cells. eLife 11, e75827.
参考文献
1.Pluvinage, J.V. et al. CD22 blockade restores homeostatic microglial phagocytosis in ageing brains. Nature 568, 187-192 (2019).
2.Merlini, M. et al. Fibrinogen Induces Microglia-Mediated Spine Elimination and Cognitive Impairment in an Alzheimer's Disease Model. Neuron 101, 1099-1108.e6 (2019).
3.Filipello, F. et al. The Microglial Innate Immune Receptor TREM2 Is Required for Synapse Elimination and Normal Brain Connectivity. Immunity 48, 979-991 e8 (2018).
4.Hong, S. et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science 352, 712-716 (2016).
5.VanRyzin, J.W. et al. Microglial Phagocytosis of Newborn Cells Is Induced by Endocannabinoids and Sculpts Sex Differences in Juvenile Rat Social Play. Neuron 102, 435-449 e6 (2019).
6.Sierra, A. et al. Microglia shape adult hippocampal neurogenesis through apoptosis-coupled phagocytosis. Cell Stem Cell 7, 483-95 (2010).
7.Berglund, R. et al. Microglial autophagy–associated phagocytosis is essential for recovery from neuroinflammation. Science Immunology 5, eabb5077 (2020).
8.Zhou, T. et al. Microvascular endothelial cells engulf myelin debris and promote macrophage recruitment and fibrosis after neural injury. Nat Neurosci 22, 421-435 (2019).
9.Goldmann, T. et al. Origin, fate and dynamics of macrophages at central nervous system interfaces. Nat Immunol 17, 797-805 (2016).
10.Ajami, B., Bennett, J.L., Krieger, C., Tetzlaff, W. & Rossi, F.M. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nat Neurosci 10, 1538-43 (2007).
11.Ginhoux, F. & Garel, S. The mysterious origins of microglia. Nat Neurosci 21, 897-899 (2018).
12.Mildner, A. et al. Microglia in the adult brain arise from Ly-6ChiCCR2+ monocytes only under defined host conditions. Nat Neurosci 10, 1544-53 (2007).
13.Reu, P. et al. The Lifespan and Turnover of Microglia in the Human Brain. Cell Rep 20, 779-784 (2017).
14.Askew, K. et al. Coupled Proliferation and Apoptosis Maintain the Rapid Turnover of Microglia in the Adult Brain. Cell Rep 18, 391-405 (2017).
15.Fuger, P. et al. Microglia turnover with aging and in an Alzheimer's model via long-term in vivo single-cell imaging. Nat Neurosci 20, 1371-1376 (2017).
16.Tay, T.L. et al. A new fate mapping system reveals context-dependent random or clonal expansion of microglia. Nat Neurosci 20, 793-803 (2017).
17.Huang, Y. et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nat Neurosci 21, 530-540 (2018).
18.Parkhurst, C.N. et al. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell 155, 1596-609 (2013).
19.Elmore, M.R. et al. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron 82, 380-97 (2014).
20.Huang, Y. et al. Dual extra-retinal origins of microglia in the model of retinal microglia repopulation. Cell Discov 4, 9 (2018).
21.Xu, Z. et al. Efficient Strategies for Microglia Replacement in the Central Nervous System. Cell Rep 32, 108041 (2020).
22.Rao, Y. et al. NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming. Neuron 109, 4094-4108.e5 (2021).
23.Zhou, T. et al. Microglial debris is cleared by astrocytes via C4b-facilitated phagocytosis and degraded via RUBICON-dependent noncanonical autophagy in mice. Nature Communications (2022).